Un approvisionnement adéquat en sang est essentiel au fonctionnement normal du cerveau. D'un autre côté, les déficits du flux sanguin cérébral et le dysfonctionnement de la barrière hémato-encéphalique sont des signes précoces de troubles neurodégénératifs chez l'homme et les modèles animaux.

Un approvisionnement suffisant en sang des 86 milliards de neurones du cerveau humain, est obtenu grâce à un vaste réseau vasculaire bien régulé d'artères, d'artérioles, de capillaires, de veinules et de veines atteignant environ 600 km de longueur. L'activité neuronale déclenche une augmentation de l'approvisionnement régional en sang oxygéné en quelques millisecondes. C'est ce que l'on appelle la réponse hémodynamique ou le couplage reurovasculaire.
Deux nouvelles études décrivent les éléments de la physiologie neurovasculaire qui rendent cet exploit possible. L'un, publié dans Nature le 19 février 2020 et dirigé par Chenghua Gu à la Harvard Medical School, rapporte que les cellules endothéliales qui tapissent les artérioles arborent une myriade d'entrées, appelées cavéoles, qui contrôlent en quelque sorte la dilatation rapide des artérioles en réponse à la stimulation neuronale. L'autre, publié le 20 janvier dans Nature Communications et dirigé par Martin Lauritzen de l'Université de Copenhague, décrit des sphincters spécialisés qui contrôlent le flux sanguin des artérioles du cerveau vers ses vastes lits capillaires.
En plus de la maladie d'Alzheimer, le système vasculaire cérébral a été impliqué dans la pathogenèse de la démence frontotemporale, la maladie de Parkinson, la maladie de Huntington, la sclérose latérale amyotrophique (SLA), la sclérose en plaques et d'autres conditions neurodégénératives telles que le trouble neurocognitif induit par le VIH.
Les patients SLA développent également des déficits de perfusion dans le cortex fronto-pariétal.
Le modèle conventionnel postule que la réponse hémodynamique est médié par des facteurs vasodilatateurs dérivés des neurones qui détendent directement les cellules musculaires lisses artérielles. Pourtant, d'après des travaux récents, il semble que les cellules endothéliales cérébrales puissent également détecter l'activité neuronale. Peut-être alors que les signaux vasodilatateurs agissent d'abord sur les cellules endothéliales cérébrales avant d'être relayés aux cellules musculaires lisses artérielles.
Chow et al. explorent ce potentiel couplage neurovasculaire médiée par les cellules endothéliales cérébrales en adoptant une approche très élégante. Ils se sont concentré sur le cortex somatosensible de souris de laboratoire, où la stimulation des moustaches déclenche de manière fiable l'activité neurale, la dilatation des vaisseaux et le flux sanguin. Ils montrent que la détection classique d’oxyde nitrique dans les cellules musculaires lisses est insuffisante pour un couplage neurovasculaire complet.
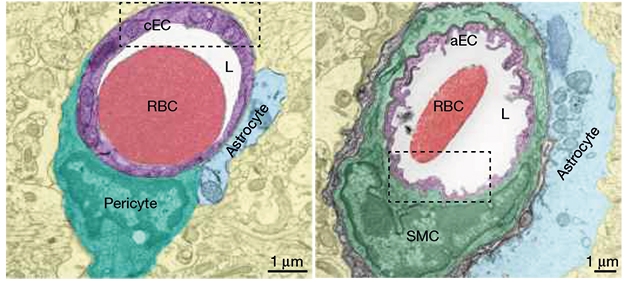
Au lieu de cela, les cavéoles enrichies en cellules endothéliales cérébrales artériolaires sont également nécessaires pour un couplage efficace. À l'aide de divers modèles de souris spécifiques au type cellulaire et de gène global de knockout et de surexpression, ils confirment que les cavéoles dans les cellules endothéliales cérébrales – et non les cellules musculaires lisses artérielles - sont nécessaires pour le couplage neurovasculaire.
Ces découvertes inspirent des questions passionnantes pour comprendre la biologie du système vasculaire cérébral en matière de santé, de vieillissement et de maladie.
Quel est le mécanisme par lequel les cavéoles médient le couplage neurovasculaire? Quelles sont les molécules vasodilatatrices spécifiques? Existe-t-il des mécanismes pour engager préférentiellement les cavéoles cellules endothéliales cérébrales par rapport à la voie oxyde nitrique? Comment les changements documentés de l'expression des gènes cellules endothéliales cérébrales avec le vieillissement sont-ils liés au couplage neurovasculaire? Enfin, comment ce modèle évolue-t-il avec la maladie? Par exemple, l'accumulation vasculaire de β-amyloïde dans l'angiopathie amyloïde cérébrale a été corrélée à une perte de cellules musculaires lisses artérielles.
En bref, la présente étude donne un nouvel élan à l'étude de la complexité fascinante du système vasculaire cérébral et, espérons-le, ouvrira la voie à une meilleure compréhension de la façon dont cette structure dégénère avec l'âge et la maladie.

